2.1.1.- Los átomos
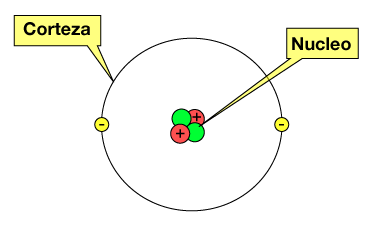
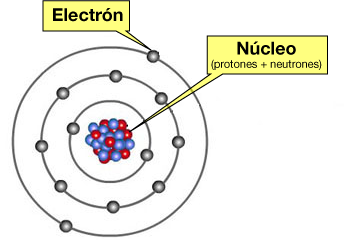
Los átomos son los componentes básicos de la materia. Un átomo está constituido por:
- Una corteza donde se encuentran los electrones (con carga eléctrica negativa)
- Un núcleo que es la parte central del átomo, formado por los protones y neutrones.
En el núcleo se concentra aproximadamente el 99.99% de la masa total del átomo y tiene carga positiva.
Los átomos son muy pequeños, mucho, tanto que no se ven ni con el más potente de los microscopios. Pero a pesar de ello los científicos tienen medios para averiguar lo grandes que son, para medirlos.
Esas medidas les llevan a la sorprendente conclusión de que el espacio que ocupa el núcleo es enormemente reducido respecto al del átomo.
Tanto que si el núcleo tuviese el tamaño de un garbanzo y lo situásemos en el centro de un campo de futbol, el átomo sería una esfera (casi hueca) cuyos límites pasarían por las porterías del campo.
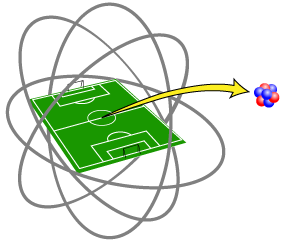
Con mayor precisión podemos afirmar que el volumen del átomo es unas 1015 veces mayor que el volumen del núcleo.
Junto al símbolo, en cada casilla de la tabla periódica aparece un numerito (arriba a la izquierda) ¿Te has dado cuenta?
Pues bien, ese numerito se llama número atómico y nos dice el número de protones que todos los átomos de ese tipo tienen en su núcleo. Se representa por la letra Z.
Normalmente los átomos son neutros, tienen el mismo número de cargas eléctricas positivas que negativas, es decir, tienen el mismo número de electrones que de protones.
En la naturaleza hay 92 tipos de átomos diferentes (y otros cuantos más obtenidos de forma artificial). Cada uno de ellos tiene su nombre y, además, para representarlo de forma sencilla los científicos le han puesto un símbolo con una letra, a lo sumo dos, a cada átomo. Por ejemplo, el oxígeno es la O, el hidrogeno la H, el sodio Na, el cloro Cl, el carbono C, el calcio Ca y así sucesivamente.
Puedes ver los nombres y los símbolos de todos los átomos en la tabla periódica que es como se llama a la forma en la que los científicos los han organizado para poder estudiarlos más fácilmente.
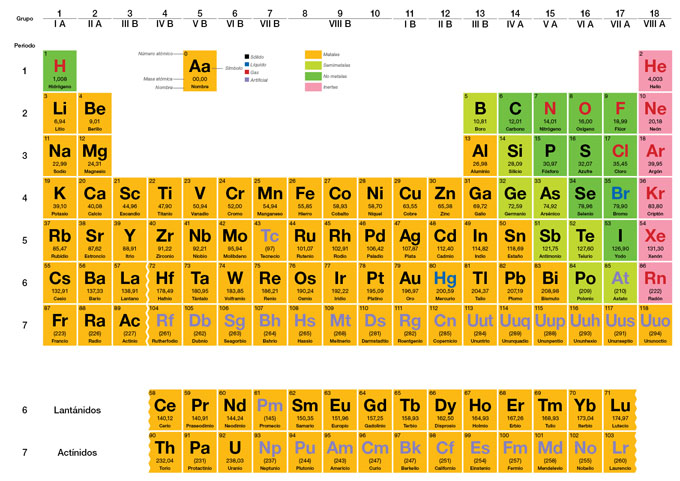
(Esta tabla es muy pequeña como para leer los nombres e incluso los símbolos, puedes ver la tabla completa haciendo clic sobre la imagen)
No te preocupes, porque no tendrás que aprendertela de memoria… !Aunque sí tendrás que saber obtener información de ella!.
Por ejemplo…
Fíjate en la casilla del carbono; el número atómico del carbono es Z = 6. Pues bien, esto significa que todos los átomos de carbono del universo tienen seis protones en su núcleo. Todos. Sin excepción. Jamás encontraremos un átomo de carbono que tenga, por ejemplo, 5 protones; un átomo con cinco protones será, necesariamente, un átomo de boro.
Por supuesto, si los átomos de carbono tienen siempre 6 protones, también tendrán 6 electrones, claro.
¿Y qué pasa con los neutrones?
Aunque todos los átomos de un mismo tipo tienen siempre el mismo número de protones, no sucede lo mismo con el número de neutrones.
Por ejemplo, hay átomos de carbono que tienen 6, 7 e incluso 8 neutrones. Pero esto no afecta a que sean átomos de carbono (claro, mientras sigan teniendo 6 protones, por supuesto)
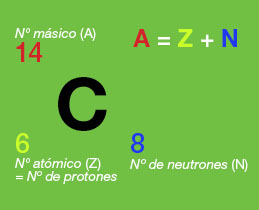
Al número conjunto de protones y neutrones de un átomo (a la suma de los dos) se le llama número másico y se representa por la letra A.
Una forma habitual de ofrecer toda la información sobre un átomo (símbolo, número de protones, número de electrones y número de neutrones) es escribirlo así: ![]()
Por ejemplo, en la imagen se representa un átomo de carbono 14, que tiene 6 protones y 8 neutrones. Su número másico es, por tanto, 6 + 8 = 14.
Dos átomos del mismo tipo, con el mismo número de protones, pero que tengan distinto número de neutrones, se dice que son isótopos.
Practica todo esto de los átomos, Z, A,... construyendo los átomos que se te propone en la siguiente animación. ¡Ah, y no olvides de contar bien!
Para saber más…
La tabla periódica no ha sido siempre como hoy la conocemos. De hecho, hace dos siglos ni tan siquiera exisitía.
Si quieres saber un poco más sobre ella, pulsa el enlace que te mostrará una...
Autoevaluación
1. ¿En qué parte de los átomos se concentra la mayor parte de su masa?
|
En el núcleo
| |
|
En la corteza
| |
|
Se encuentra uniformemente distribuida por todo el átomo.
|
|
El neutrón.
| |
|
El electrón.
| |
|
El protón.
|
|
Co
| |
|
C
| |
|
Cu
|
|
Z = 8 y A = 10
| |
|
Z = 8 y A = 18
| |
|
Z = 18 y A = 10
|